Dalam Kimia Organik ada 4 unsur yang
harus dimengerti atau dipahami diantaranaya adalah C (carbon), H (Hidrogen), O
(Oksigen) dan N (Nitrogen). Keempat unsur ini ada di kedua periode pertama dari
susunan dan elektronnya terdapat dalam dua kulit elektron yang paling dekat dengan
inti.
Setiap kulit elektron berhubungan dengan
sejumlah energi tertentu. Elektron yang paling dekat dengan inti lebih tertarik
oleh proton dalam inti daripada elektron yang lebih jauh kedudukannya. Karena
itu, semakin dekat elektron terdapat ke inti, semakin rendah energinya, dan
elektron ini sukar berpindah dalam reaksi kimia. Kulit elektron yang terdekat
ke inti adalah kulit yang terendah energinya, dan elektron dalam kulit ini
dikatakan berada pada tingkatan energi pertama. Elektron dalam kulit kedua,
yaitu pada tingkat energi kedua mempunyai energi yang lebih tinggi daripada
elektron dalam tingkat pertama, dan elektron dalam tingkat ketiga atau pada
tingkat energi ketiga, mempunyai energi yang lebih tinggi lagi.
Susunan Elektron dalam
Atom dapat dijelaskan menggunakan konfigurasi elektron. Penyusunannya dalam
Atom didasarkan pada teori-teori tertentu yaitu diantaranya adalah Teori
Dualisme Gelombang Partikel, Azas ketidakpastian, dan Teori Persamaan
Gelombang. Teori Dualisme gelombang partikel yang dikemukaan oleh De Broglie
pada tahun 1924, teori ini menyatakan elektron dalam atom bersifat gelombang
dan partikel. Azas Ketidakpastian yang dikemukakan oleh Heisenberg pada tahun
1927, menyatakan bahwa posisi dan momentum partikel tidak dapat ditentukan secara
pasti dalam waktu bersamaan. Teori ini menyimpulkan bahwa lintasan elektron
tidak berbentuk lingkaran. Dan Teori Persamaan Gelombang yang diemukakan oleh
Erwin Schrodinger, menerangkan bahwa pergerakan partikel-partikel mikroskopik
termasuk Elektron.
Azas Ketidakpastian
menurut Heisenberg, menyebabkan posisi elektron tidak ditentukan dengan pasti
demikian pula dengan elektron dalam atom menurut Mekanika Kuantum. Walaupun
orbit elektron tidak dapat ditentukan dengan pasti, tetapi peluang untuk
menentukan elektron pada posisi tertentu disekitar inti masih mungkin untuk
ditentukan. Orbital merupakan daerah disekitar inti dengan peluang terbesar
untuk menetunkan elektron. Kapasitas maksimal orbital untuk ditempati elektron
sebesar 2 elektron. Orbital juga ini sering disebut tingkat energi. Hanya
elektron dengan energi yang cocok dapat menempati orbital tersebut. Sistem
susunan elektron dalam Atom dapat dilihat pada tabel gambar berikut :
Orbital Atom
Orbital atom merupakan bagian dari ruang di
mana kebolehjadian ditemukannya sebuah elektron dengan kadar energi yang khas
(90% - 95%). Rapat elektron adalah istilah lain yang digunakan untuk
menggambarkan kebolehjadian ditemukannya sebuah elektron pada titik tertentu;
rapat elektron yang lebih tinggi, berarti kebolehjadiannya lebih tinggi,
sedangkan rapat elektron yang lebih rendah berarti kebolehjadiannya juga
rendah.
Kulit elektron pertama hanya mengandung
orbital bulat 1s. Kebolehjadian untuk menemukan elektron 1s adalah tertinggi
dalam bulatan ini. Kulit kedua, yang agak berjauhan dari inti daripada kulit
pertama, mengandung satu orbital 2s dan tiga orbital 2p. Orbital 2s seperti
orbital 1s, adalah bulat.
B. Jari-Jari Atom dan Keeloktronegatifan
Salah
satu keunikan dari tabel periodik adalah unsur-unsur kimia disusun berdasarkan
kemiripan sifat-sifatnya. Sifat-sifat suatu unsur dalam satu golongan maupun
periode menunjukkan pengulangan yang teratur (periodik).
1.
Sifat
Keperiodikan Jari-Jari Atom
Dalam
segolongan, jari-jari atom akan semakin besar dari atas ke bawah. Hal ini
terjadi karena dari atas ke bawah jumlah kulit bertambah sehingga jari-jari
atom juga bertambah.
Dalam
seperiode, (dari kiri ke kanan) berjumlah kulit sama tetapi jumlah proton
bertambah sehingga jari-jari atom juga berubah. Karena jumlah proton bertambah
maka muatan inti juga bertambah yang mengakibatkan gaya tarik menarik antara
inti dengan elektron pada kulit terluar semakin kuat. Kekuatan gaya tarik yang
semakin meningkat menyebabkan jari-jari atom semakin kecil. Sehingga untuk unsur
dalam satu periode, jari-jari atom semakin kecil dari kiri ke kanan.
2.
Sifat
Keperiodikan Energi Ionisasi
Energi
minimum yang dibutuhkan untuk melepas elektron atom netral dalam wujud gas pada
kulit terluar dan terikat paling lemah disebut energi ionisasi. Nomor atom dan
jari-jari atom mempengaruhi besarnya energi ionisasi. Semakin besar jari-jari
atom maka gaya tarik antara inti dengan elektron pada kulit terluar semakin
lemah. Hal ini berarti elektron pada kulit terluar semakin mudah lepas dan energi
yang dibutuhkan untuk melepaskan elektron tersebut semakin kecil. Akibatnya,
dalam satu golongan, energi ionisasi semakin kecil dari atas ke bawah. Sedagkan
dalam satu periode, energi ionisasi semakin besar dari kiri ke kanan. Hal ini
disebabkan dari kiri ke kanan muatan inti semakin besar yang mengakibatkan gaya
tarik antara inti dengan elektron terluar semakin besar sehingga dibutuhkan
energi yang besar pula untuk melepaskan elektron pada kulit terluar.
Hubungan energi ionisasi dengan
nomor atom
Kurva tersebut menunjukkan unsur golongan 8A
berada di puncak grafik yang mengindikasikan bahwa energi ionisasinya besar.
Hal sebaliknya terjadi untuk unsur golongan 1A yang berada di dasar kurva yang
menunjukkan bahwa energi ionisasinya kecil. Atom suatu unsur dapat melepaskan
elektronnya lebih dari satu buah. Energi yang dibutuhkan untuk melepaskan
elektron keuda disebut energi ionisasi kedua dan tentu saja diperlukan energi
yang lebih besar. Energi ionisasi semakin besar apabila makin banyak elektron yang
dilepaskan oleh suatu atom.
3.
Sifat
Keperiodikan Afinitas Elektron
Afinitas
elektron adalah energi yang dibebaskan suatu atom dalam wujud gas untuk
membentuk ion negatif. Jika ion negatif yeng terbentuk bersifat stabil, maka
proses penyerapan elektron itu disertai pelepasan energi dan afinitas
elektronnya dinyatakan dengan tanda negatif. Akan tetapi jika ion negatif yang
terbentuk tidak stabil, maka proses penyerapan elektron akan membutuhkan energi
dan afinitas elektronnya dinyatakan dengan tanda positif. Jadi, unsur yang
mempunyai afinitas elektron bertanda negatif mempunyai kecenderungan lebih
besar menyerap elektron daripada unsur yang afinitas elektronnya bertanda
positif. Makin negatif nilai afinitas elektron berarti makin besar
kecenderungan menyerap elektron.
Dalam satu
periode dari kiri ke kanan, jari-jari semakin kecil dan gaya tarik inti
terhadap elektron semakin besar, maka atom semakin mudah menarik elektron dari
luar sehingga afinitas elektron semakin besar.
Pada satu
golongan dari atas ke bawah, jari-jari atom makin besar, sehingga gaya tarik
inti terhadap elektron makin kecil, maka atom semakin sulit menarik elektron
dari luar, sehingga afinitas elektron semakin kecil.
4.
Sifat
Keperiodikan Keelektronegatifan
Kelektronegatifan
adalah kemampuan suatu atom untuk menarik elektron dari atom lain. Faktor yang
mempengaruhi keelektronegatifan adalah gaya tarik dari inti terhadap elektron
dan jari-jari atom.
Unsur-unsur
yang segolongan : keelektronegatifan makin ke bawah makin kecil, karena gaya
taik-menarik inti makin lemah. Unsur-unsur bagian bawah dalam sistem periodik
cenderung melepaskan elektron.
Unsur-unsur
yang seperiode : keelektronegatifan makin kekanan makin besar. Keelektronegatifan
terbesar pada setiap periode dimiliki oleh golongan VII A (unsur-unsur
halogen). Harga kelektronegatifan terbesar terdapat pada flour (F) yakni 4,0,
dan harga terkecil terdapat pada fransium (Fr) yakni 0,7.
Harga
keelektronegatifan penting untuk menentukan bilangan oksidasi ( biloks ) unsur
dalam sutu senyawa. Jika harga kelektronegatifan besar, berati unsur yang
bersangkutan cenderung menerima elektron dan membentuk bilangan oksidasi
negatif. Jika harga keelektronegatifan kecil, unsur cenderung melepaskan
elektron dan membentuk bilangan oksidasi positif. Jumlah atom yang diikat
bergantung pada elektron valensinya.
C.
Panjang Ikatan
dan Sudut Ikatan
Teori VSEPR Dan Geometri Molekul
Geometri molekul atau sering disebut struktur
molekul atau bentuk molekul yaitu gambaran tiga dimensi dari suatu molekul yang
ditentukan oleh jumlah ikatan dan besarnya sudut-sudut yang ada disekitar atom
pusat.
Perlu
ditekankan istilah molekul hanya berlaku untuk atom-atom yang berikatan secara
kovalen. Karena hal inilah, istilah
geometri molekul hanya ditujukan pada senyawa kovalen ataupun ion-ion
poliatomik.
Di dalam
sebuah molekul atau ion poliatom terdapat atom pusat dan substituent-substituent.
Substituent yang ada terikat pada atom pusat.
Substituent-substituent ini dapat berupa atom (misalnya Br atau H) dan dapat
pula berupa gugus (misalnya NO2).
1. Terkadang sulit untuk menentukan atom pusat dari suatu
molekul atau ion poliatomik. Berikut
beberapa cara yang dapat digunakan untuk menentukan atom pusat yaitu sebagai
berikut.
2.
Atom pusat biasanya ditulis di awal rumus formulanya.
3. Atom pusat biasanya atom yang lebih elektropositif atau
kurang elektronegatif.
4. Atom pusat biasanya atom yang memiliki ukuran lebih
besar dari atom atau susbstituen-substituen yang ada. H ukuran paling kecil
sehingga tidak pernah berlaku sebagai atom pusat.
Contoh:
BeCl2 atom pusatnya
adalah Be
NH3 atom pusatnya
adalah N
Elektron
valensi atom pusat yang digunakan pada pembentukan senyawa kovalen terkadang
digunakan untuk membentuk ikatan kadang tidak digunakan. Elektron
yang tidak digunakan ditulis sebagai pasangan elektron bebas (PEB), sedangkan
elektron yang digunakan dalam pembentukan ikatan ditulis sebagai pasangan
elektron ikatan (PEI). Selain PEB
dan PEI pada atom pusat dapat pula terdapat elektron tidak berpasangan seperti
pada molekul NO2.
Dalam suatu
molekul elektron-elektron tersebut saling tolak-menolak karena memiliki muatan
yang sama. Untuk
mengurangi gaya tolak tersebut atom–atom yang
berikatan membentuk struktur ruang tertentu hingga tercapai gaya tolak yang
minimum. Akibat yang
ditimbulkan dari tolakan yang yang terjadi yaitu mengecilnya sudut ikatan dalam
molekul. Urutan gaya
tolak dimulai dari gaya tolak yang terbesar yaitu sebagai berikut:
1. Gaya
tolak antar sesama elektron bebas (PEB vs PEB)
2. Gaya
tolak antara pasangan elektron bebas dengan elektron ikatan (PEB vs PEI)
3. Gaya
tolak antar pasangan elektron ikatan (PEI vs PEI).
Teori yang
digunakan untuk mempelajari gaya tolak antar sesama elektron valensi disebut
teori VSEPR (Valence Shell Electron Pair Repulsion)
yang dikembangkan oleh Gillespie dan Nylholm sehigga sering disebut sebagai
teori Gillespie-Nylholm. Dengan
teori ini ternyata struktur ruang suatu senyawa dapat ditentukan dengan
memperhatikan elektron bebas dan elektron ikatan dari senyawa yang
bersangkutan.
Rundle
menyatakan teori VSEPR terlalu “naive” dan satu-satunya cara
pendekatan dalam meramalkan bentuk molekul adalah teori orbital molekul.
Gillespie menantang Rundle meramal bentuk molekul dari ksenon fluorida (XeF6)
yang pada saat itu baru saja disintesis oleh Malm dan rekan-rekannya.
Berdasarkan
terori orbital molekul, Rundle menyatakan bentuk molekul XeF6
adalah oktahedral normal. Sedangkan Gillespie berdasarkan teori VSEPR
menyatakan bentuk molekul XeF6 adalah oktahedral terdistorsi.
Berdasarkan
hasil eksperimen metode spektroskopi inframerah terhadap XeF6 yang dilakukan
oleh Bartell diperoleh fakta bahwa bnetuk molekul XeF6 adalah oktahedral
terdistorsi yang diramalkan Gillespie. Sejak saat itu teori VSEPR menjadi
terkenal dan Bartell menyatakan “The VSEPR model some capture the essence
of molecular behaviour” .
Beberapa Bentuk Molekul
Berdasarkan Teori VSEPR
Pada
penentuan struktur ruang molekul-molekul berdasarkan teori VSEPR umumnya atom
pusat atom pusat dilambangkan dengan A, jumlah atom yang diikat atau jumlah
pasangan elektron ikatan (PEI) dilambangkan dengan X dan pasangan elektron
bebas atom pusat dilambangkan dengan E. Berbagai
struktur ruang molekul dapat dilihat pada Tabel.
Nama
|
Sudut ikatan
|
Jumlah PEI (X)
|
Jumlah PEB (E)
|
Rumus (AXnEm)
|
Bentuk Molekul
|
Contoh senyawa
|
Linear
|
180
|
2
|
0
|
AX2
|
CO2
|
|
Trigonal planar
|
120
|
3
|
0
|
AX3
|
BF3
|
|
Planar huruf V
|
2
|
1
|
AX2E
|
SO2
|
||
Tetrahedral
|
4
|
0
|
AX4
|
CH4
|
||
Piramida trigonal
|
3
|
1
|
AX3E
|
NH3
|
||
Planar bentuk V
|
2
|
2
|
AX2E2
|
H2O
|
||
Bipiramida trigonal
|
5
|
0
|
AX5
|
PCl5
|
||
Bipiramida trigonal
|
4
|
1
|
AX4E
|
SF4
|
||
Planar bentuk T
|
3
|
2
|
AX3E2
|
ClF3
|
||
Linear
|
2
|
3
|
AX2E3
|
XeF2
|
||
Oktahedral
|
90
|
6
|
0
|
AX6
|
SF6
|
|
Piramida segiempat
|
5
|
1
|
AX5E
|
BrF5
|
||
Segiempat datar
|
4
|
2
|
AX4E2
|
XeF4
|
Keterangan: PEI = pasangan
elektron ikatan, PEB = pasangan elektron bebas, A= atom pusat, Xn =
jumlah atom yang diikat atom pusat, Em = jumlah pasangan elektron
bebas.
Pada Tabel
di atas, nama bentuk molekul yang diberi huruf tebal merupakan bentuk molekul
dasar karena semua elektron valensi atom pusat digunakan untuk membentuk
ikatan.
Jika
terdapat elektron yang tidak digunakan untuk membentuk ikatan atau elektron
bebas ditunjukan dengan garis putus-putus kemudian dua titik yang menyatakan
pasangan elektron bebas.
Keterbatasan
Teori VSEPR
Seperti
teori-teori yang lain, teori VSEPR juga memiliki kelemahan-kelemahan. Beberapa
diantaranya sebagai berikut.
Banyak
senyawa logam transisi strukturnya tidak dapat dijelaskan menggunakan teori
VSEPR. Teori VSPER gagal meramalkan struktur NH3+.
Berdasarkan teori VSEPR bentuk molekul NH3+ adalah
trigonal bipiramidal dengan sudut ikatan lebih kecil dari 120° (sudut normal
untuk atom dengan bilangan koordinasi 3) tetapi lebih besar dari 109,47° (sudut
normal untuk atom bilangan koordiansi 4) karena terdapat satu elektron tidak
berpasangan pada atom N.
Namun
berdasarkan hasil eksperimen ternyata bentuk dari NH3+
adalah segitiga planar dengan sudut ikatan sebesar 120°. Hal ini disebabkan
elektron bebas terdistribusi secara merata pada bagian depan belakang atom N.
Bentuk trigonal piramidal dan trigonal planar seperti yang ditunjukan pada
gambar.
Struktur
senyawa halida triatomik dengan logam golongan 2 tidaklah linear pada fase gas
seperti yang diprediksi oleh teori VSEPR, melainkan berbentuk tekuk (sudut
X-M-X : CaF2, 145°; SrF2, 120°; BaF2, 108°;
SrCl2, 130°; BaCl2, 115°; BaBr2, 115°; BaI2,
105°). Gillespie mengajukan bahwa ini disebabkan oleh interaksi ligan dengan
elektron pada inti atom logam yang menyebabkan polarisasi atom, sehingga
kelopak dalam atom tidaklah simetris berbentuk bola dan memengaruhi geometri
molekul.
Teori VSEPR
dapat digunakan untuk meramal bentuk molekul dari hidrida-hidrida unsur-unsur
pada periode 3 dan 4 seperti H2S, H2Se, PH3,
AsH3 dan SbH3, namun gagal meramal besar sudut ikatan
yang ada.
Berdasarkan teori VSEPR H2S
dan H2Se berbentuk huruf V dengan besar sudut ikatan H-E-H (E=S atau
Se) sekitar 104,5°C seperti sudut ikatan H2O. Namun berdasarkan eksperimen diperoleh besar
sudut H-E-H mendekati 90° walaupun berbentuk V.
Sedangkan bentuk molekul PH3,
AsH3 dan SbH3 berdasarkan teori VSEPR berbentuk trigonal
piramidal dengan sudut ikatan H-E-H (E = P, As atau Sb) sekitar 107,3° seperti
sudut ikatan NH3. Namun berdasarkan eksperimen diperoleh bahwa
besar sudut ikatan H-E-H m,endekati 90° walaupun berbentuk trigonal piramidal.
D.
Energi
disosiasi
1.
Entalpi dan Perubahan Entalpi
Pengertian
Entalpi
Entalpi
adalah kandungan kalor sistem dalam tekanan tetap. Entalpi di lambangkan dengan H,
sedangkan perubahan entalpi adalah selisih antara entalpi akhir dan entalpi
awal di simbolkan dengan dengan DH.
ΔH
= Hakhir – Hmula-mula
Walaupun
ini merupakan definisi yang biasa dari DH, keadaan
entalpi H, mula-mula dan akhir (yang sebenarnya berhubungan
dengan jumlah energi yang ada pada keadaan ini) tidak dapat di ukur. Ini di
sebabkan jumlah energi total dari sistem adalah jumlah dari semua energi
kinetik dan energi potensialnya. Jumlah energi total ini tidak dapat di ketahui
karena kita tidak dapat mengetahui secara pasti berapa kecepatan pergerakan
molekul-molekul dari sistem dan juga beberapa gaya tarik menarik dan tolak
menolak antara molekul dalam sistem tersebut. Bagaimanapun, defenisi di atas
sangat penting karena telah menegakkan tanda aljabar DH eksoterm
dan endoterm. Perubahan eksoterm, Hakhir lebih
kecil dari Hmula-mula. Jadi harga DH adalah
negatif. Dengan analisis yang sama, kita mendapatkan bahwa harga DH untuk
perubahan endoterm adalah positif (Brady, Kimia Universitas Asas &
Struktur. Hal. 274).
Jika
reaksi kimia meningkatkan panas, sistem kehilangan panas dan panas tersebut
hilang pada tekanan konstan adalah berkurangnya dalam entalpi (DH<0).
Reaksi seperti itu dengan DH negatif adalah eksotermik.
Pembakaran etana adalah reaksi eksotermis yang sangat kuat ; CH4 (g) + O2 (l) --> CO2(g)
+ 2H2O
(l) DH
< 0, eksotermis
Hasil
reaksi ini memberikan entalpi lebih rendah daripada reaktan. Dalam reaksi
endotermis, panas di serap oleh reaksi dari lingkungan, membuat DH bernilai
positif. Sebagai contoh reaksi endotermis adalah pembentukan nitrogen oksida
dari unsurnya.
N2 (g)
+ 2 O2 (g) -->2NO2 (g) DH
> 0, endotermis
(Widi Prasetiawan, Kimia Dasar 1. Hal.97
2.
Proses
Eksoterm dan Endoterm
Hukum pertama
termodinamika menunjukan bahwa perubahan energi dalam (ΔU) tidak dapat diukur,
tetapi dapat di hitung dari nilai kalor (q) dan kerja (w) (syukri, Kimia Dasar
1. Hal79).
Jika kalor yang
menyertai perubahan pada volume tetap adalah ΔU maka kalor pada tekanan
tetap adalah ΔH. Hubungan antara energi dalam dan entalpi adalah :
ΔH = ΔU + Δ(PV), dapat di tuliskan
H = U + PV
(Olimpiade
kimia SMA. Hal 63)
a. Perubahan
Entalpi Pembentukan Standar (ΔH o f)
= kalor pembentukan
Adalah
perubahan entalpi yang terjadi pada pembentukan 1 mol senyawa dari unsur-unsurnya pada
suhu dan tekanan standar ( 25 oC, 1 atm ). Entalpinya
bisa dilepaskan maupundiserap. Satuannya adalah kJ / mol.
Catatan:
1) ΔHf elemen
stabil adalah 0
2) ΔHf digunakan
untuk memperkirakan stabilitas senyawa dibanding penyusunnya
3) Semakin
kecil ΔHf, semakin stabil energi senyawa itu
4) ΔHf tidak
mencerminkan laju reaksi (akan dibahas pada bab selanjutnya)
b. Perubahan
Entalpi Penguraian Standar (ΔH o d)
Adalah
perubahan entalpi yang terjadi pada penguraian1 mol senyawa menjadi
unsur-unsur penyusunnya pada keadaan standar. Perubahan entalpi penguraian
standar merupakan kebalikandari perubahan entalpi pembentukan
standar, maka nilainya pun akan berlawanan tanda.
Menurut Marquis
de Laplace, “ jumlah kalor yang dilepaskan pada pembentukan senyawa
dari unsur-unsur penyusunnya = jumlah kalor yang diperlukan pada penguraian
senyawa tersebut menjadi unsur-unsur penyusunnya. “ Pernyataan ini
disebut Hukum Laplace.
c. Perubahan
Entalpi Pembakaran Standar (ΔH o c)
Adalah
perubahan entalpi yang terjadi pada pembakaran 1 mol suatu zat secara
sempurna pada keadaan standar. Catatan:
1) ΔHc
selalu negatif, karena panas pasti dilibatkan
2) ΔHc
bisa digunakan untuk menilai kandungan energi bahan bakar atau makanan
d. Perubahan
Entalpi Netralisasi Standar (ΔH o n)
Adalah
perubahan entalpi yang terjadi pada penetralan 1 mol asam oleh
basa atau 1 mol basa oleh asam pada keadaan standar.
e.
Perubahan Entalpi Penguapan Standar
(ΔH ovap)
Adalah perubahan entalpi yang terjadi
pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada
keadaan standar.
f.
Perubahan Entalpi Peleburan Standar
(ΔH ofus
)
Adalah
perubahan entalpi yang terjadi pada pencairan / peleburan 1 mol zat
dalam fase padat menjadi zat dalam fase cair pada keadaan standar.
g.
Perubahan Entalpi Sublimasi Standar
(ΔH osub
)
Adalah
perubahan entalpi yang terjadi pada sublimasi 1 mol zat dalam fase
padat menjadi zat dalam fase gas pada keadaan standar.
h.
Perubahan Entalpi Pelarutan Standar
(ΔH osol
)
Adalah
perubahan entalpi yang terjadi ketika 1 mol zat melarut dalam
suatu pelarut ( umumnya air ) pada keadaan standar. Catatan:
1) Jika
ΔHs sangat positif, zat itu tidak larut dalam air
2) Jika
ΔH negatif, zat itu larut dalam air
4.
Penentuan Perubahan Entalpi
Energi
ikatan adalah energi yang diperlukan untuk memutuskan ikatan kimia dalam 1 mol
suatu molekul / senyawa berwujud gas menjadi atom-atomnya.
Lambang energi ikatan = D. Energi ikatan rerata pada ikatan
rangkap 3 > ikatan rangkap 2 > ikatan tunggal. Suatu reaksi
yangDH–nya ditentukan dengan menggunakan energi ikatan, maka atom-atom yang
terlibat dalam reaksi harus berwujud gas. Berdasarkan jenis dan letak atom
terhadap atom-atom lain dalam molekulnya, dikenal 3 jenis energi ikatan yaitu :
1) Energi Atomisasi
Adalah
energi yang diperlukan untuk memutuskan semua ikatan 1 mol molekul menjadi
atom-atom bebas dalam keadaan gas. Energi atomisasi = jumlah seluruh ikatan
atom-atom dalam 1 mol senyawa.
Contoh
:
Pada
molekul NH3 terdapat 3 ikatan N – H. Sementara itu, energi
ikatan N – H = 93 kkal / mol sehingga energi atomisasinya = 3 x 93 kkal / mol =
297 kkal / mol.
2) Energi
Disosiasi Ikatan.
Adalah
energi yang diperlukan untuk memutuskan salah 1 ikatan yang terdapat pada suatu
molekul atau senyawa dalam keadaan gas. Contoh : Energi disosiasi
untuk melepas 1 atom H dari molekul CH4 = 431 kJ.
Energi
disosiasi ikatan terkadang disebut sebagai entalpi disosiasi ikatan
(atau entalpi ikatan), namun istilah ini mungkin tidak sepenuhnya
setara. Entalpi disosiasi ikatan biasanya merujuk pada entalpi reaksi di
atas pada 298 K (kondisi
standar) dan bukan pada 0 K, serta berbeda dengan D0
sekitar 1.5 kkal/mol (6 kJ/mol) dalam hal satu ikatan pada hidrogen
dalam suatu molekul organik besar. Namun demikian, istilah energi disosiasi
ikatan dan simbol D0 telah digunakan untuk entalpi reaksi
pada 298 K pula.
Kecuali molekul diatomik, energi disosiasi ikatan berbeda
dari energi ikatan. Sementara energi disosiasi ikatan
adalah energi dari satu ikatan kimia, energi ikatan adalah rata-rata semua
energi ikatan dari seluruh ikatan dalam molekul.
Misalnya,
disosiasi ikatan HO–H dari molekul air (H2O) membutuhkan
493.4 kJ/mol. Disosiasi radikal hidroksil yang tersisa memerlukan
424.4 kJ/mol. Energi ikatan pada ikatan kovalen O–H dalam air
dikatakan sebesar 458.9 kJ/mol, rata-rata dari nilai tersebut.
Dengan cara
yang sama untuk menghilangkan atom hidrogen berturut-turut dari metana maka
energi disosiasi ikatannya adalah 104 kkal/mol (435 kJ/mol) untuk D(CH3–H),
106 kkal/mol (444 kJ/mol) untuk D(CH2–H),
106 kkal/mol (444 kJ/mol) untuk D(CH–H) dan terakhir
81 kkal/mol (339 kJ/mol) untuk D(C–H). Energi ikatan, maka,
adalah sebesar 99 kkal/mol atau 414 kJ/mol (rerata energi disosiasi
ikatan). Tak satu pun dari energi disosiasi ikatan individu yang sama dengan
energi ikatan 99 kkal/mol.
Mengikuti
disosiasi, jika ikatan baru dari energi disosiasi ikatan yang besar terbentuk,
produk ini memiliki entalpi lebih rendah, terdapat kehilangan energi, dan
karenanya proses secara keseluruhan bersifat eksotermik. Secara khusus, konversi ikatan rangkap
dua yang lemah dalam O2 menjadi ikatan yang lebih kuat dalam CO2
dan H2O membuat pembakaran
bersifat eksotermik.
Disosiasi homolitik versus heterolitik
Ikatan dapat
dipecah simetris atau asimetris. Yang pertama disebut homolisis dan merupakan
dasar bagi BDEs yang umum. Skema asimetris suatu ikatan disebut heterolisis.
Untuk hidrogen molekuler, alternatifnya adalah:
H2
→ 2 H•
ΔH = 104 kkal/mol
H2
→ H+ + H−
ΔH = 66 kkal/mol (dalam air)
3) Energi
Ikatan Rata-Rata.
Adalah
energi rerata yang diperlukan untuk memutuskan ikatan atom-atom pada suatu
senyawa ( notasinya = D ).
Contoh
:
Dalam
molekul CH4 terdapat 4 ikatan C - H .
Energi
ikatan rerata C - H ( DC-H ) = ( 1668 / 4 ) kJ =417 kJ
Energi
ikatan suatu molekul yang berwujud gas dapat ditentukan dari data entalpi
pembentukan standar (DHf ) dan energi ikat unsur-unsurnya. Prosesnya melalui 2
tahap yaitu :
a)
Penguraian senyawa menjadi
unsur-unsurnya.
b)
Pengubahan unsur menjadi atom gas.
b. Penentuan
Perubahan Entalpi Berdasarkan Hukum Hess
Hukum
Hess “Perubahan entalpi yang dilepas atau diserap tidak tergantung pada
jalannya reaksi, melainkan tergantung pada kondisi zat – zat yang bereaksi (
reaktan ) dan zat – zat hasil reaksi ( produk )”.
Berdasarkan
hukum Hess, penentuan DH dapat dilakukan melalui 2 cara, yaitu :
1)
Perubahan entalpi ( DH ) dihitung melalui penjumlahan dari perubahan
entalpi beberapa reaksi yang berhubungan.
DH = DH1 + DH2 + DH3
2)
Perubahan entalpi ( DH ) suatu reaksi dihitung berdasarkan selisih entalpi
pembentukan ( DHof ) antara produk dan reaktan
Entalpi
reaksi standar, ΔH0, adalah perubahan entalpi dari 1 mol
reaktan dan produk pada keadaan standar (105 Pa dan 298.15 K). Entalpi
pembentukan standar, ΔHf0, suatu senyawa adalah
entalpi reaksi standar untuk pembentukan senyawa dari unsur-unsurnya. Karena
entalpi adalah fungsi keadaan, entalpi reaksi standar dihitung dengan
mendefinisikan entalpi pembentukan zat sederhana (unsur) bernilai nol. Dengan
demikian:
ΔH =Σ ΔHf(produk) −ΣΔHf0(reaktan)(Taro
Saito, Kimia Anorganik 1 hal. 42)
E. Konsep asam dan basa dalam kimia
organik
1. Menurut Arrhennius
Menurut Arrhennius, asam adalah senyawa yang apabila dilarutkan dalam air akan melepaskan ion H+, sedangkan basa adalah senyawa yang apabila dilarutkan dalam air akan melepaskan ion OH-. Konsep ini hanya dapat diterapkan pada senyawa yang larut dalam air sehingga dikembangkan lagi konsep yang dapat digunakan untuk senyawa yang tidak larut dalam air. Contoh asam menurut Arrhennius:
Dari definisi Arrhenius, asam dan basa masing - masing
dibagi dua:
1) Asam kuat, yaitu asam yang terdisosiasi sempurna di dalam air dan memiliki nilai derajat disosiasi = 1. Contoh asam kuat
adalah HCl (Asam Klorida),
HNO3 (Asam Nitrat
/ Asam Sendawa), H2SO4 (Asam Sulfat), HBr
(Asam Bromida),
HI (Asam Iodida), dan HClO4 (Asam Perklorat).
2)
Asam lemah, yaitu asam yang tidak terdisosiasi sempurna di dalam air dan memiliki nilai derajat disosiasi < 1. Contoh asam lemah
adalah HNO2 (Asam Nitrit),
CH3COOH (Asam Asetat / Asam Cuka), HCOOH (Asam Format / Asam Semut), H2C2O4
(Asam Oksalat), H2S (Asam Sulfida), H2SO3
(Asam Sulfit), dan masih banyak lagi.
3)
Basa kuat, yaitu basa yang terdisosiasi sempurna di dalam air dan memiliki nilai derajat disosiasi = 1. Contoh basa kuat
adalah KOH (Kalium Hidroksida)
dan NaOH (Natrium
Hidroksida / Soda
Kaustik).
4) Basa lemah, yaitu basa yang tidak terdisosiasi sempurna di dalam air dan memiliki nilai derajat disosiasi < 1. Contoh basa lemah
adalah Fe(OH)2 (Besi (II) Hidroksida),
Fe(OH)3 (Besi (III) Hidroksida),
Al(OH)3 (Alumunium Hidroksida)
dan sebagainya.
Kelemahan
Konsep Arrhennius ialah, bahwa konsep ini hanya dapat digunakan pada zat - zat
yang memiliki ion H+ dan OH- saja, sedangkan zat - zat organik dan tidak larut
dalam air tidak dapat ditentukan sifat keasaman atau kebasaannya.
2. Menurut Brownstead – Lowry
Menurut Brownstead – Lowry, asam adalah senyawa yang mendonorkan proton (H+) sedangkan basa adalah senyawa yang menerima donor proton (H+) dari asam. Konsep ini banyak digunakan dalam reaksi - reaksi senyawa organik karena cocok untuk senyawa yang tidak memiliki H+ dan OH- dan juga tidak larut dalam air.
3. Teori Asam Basa lewis
Teori asam basa Lewis sangat baik untuk mengidentifikasi
sifat suatu reaksi dalam berbagai pelarut yang mengandung hidrogen yang dapat
terion. Tetapi, konsep ini tidak dapat menjelaskan suatu reaksi yang tidak
melibatkan transfer ion hidrogen. Lewis mengusulkan konsep asam basa berkaitan
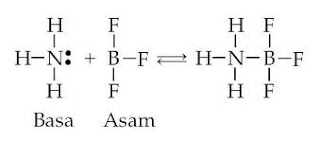
dengan donor pasangan elektron. Menurut Lewis, asam didefinisikan sebagai
penerima pasangan elektron dan basa sebagai donor pasangan elektron. Reaksi
antara boron trifluorida dengan amonia menurut teori ini merupakan reaksi
asam-basa; dalam hal ini boron trifluorida berindak sebagai asam dan amonia
sebagai basa. Dengan menggunakan diagram dot-elektron, persamaan reaksi kedua
spesies ini dapat dituliskan sebagai berikut:
Di
dalam kulit valensi atom pusat N dalam molekul NH3, terdapat tiga
pasang elektron ikatan (N-H) dan satu pasang elektron menyendiri, sedangkan
untuk atom pusat B alam molekul BF3 terdapat tiga pasang elektron
ikatan (B-F). Sepasang elektron menyendiri atom elektron non bonding ini dapat
disumbangkan kepada atom pusat B untuk kemudian dimiliki bersama-sama, Dengan
demikian terjadi ikatan kovalen koordinat B-N dan struktur yang terjadi berupa
dua bangun tetrahedron bersekutu pada salah satu sudutnya.
Banyak
dijumpai reaksi asam-basa Lewis yang paralel dengan reaksi asam-basa
Brønsted-Lowry dan diantaranya berlangsung dalam pelarut bukan air. Cairan
murni yang dapat terukur hantaran listriknya misalnya bromin trifluorida, BrF3,
tentu mengandung ion-ion. Spesies ini mengalami swa-ionisasi dengan
menghasilkan kation BrF2+ dan anion BrF4-
menurut persamaan reaksi:
Spesies
[BrF2][SbF6] dan Ag[BrF4] telah berhasil
ditemukan, dan dalam sistem pelarut cairan BrF3 (l) masing-masing
bersifat asam dan basa. Oleh karena itu keduanya bereaksi menurut reaksi netralisasi
Lewis sebagai berikut:
[BrF2][SbF6] (BrF3
) + Ag[BrF4]  Ag[SbF6] (BrF3 ) + 2 BrF3
(l)
Ag[SbF6] (BrF3 ) + 2 BrF3
(l)
Dalam konsep asam dan basa, dikenal
senyawa amfoter yaitu senyawa yang dapat bertindak sebagai asam namun dapat
juga bertindak sebagai basa. Contoh senyawa amfoter adalah air (H2O), Asam
Amino, Asam Borat (H3BO3), dan Alumunium Hidroksida (Al(OH)3).
Sifat
Kimia Asam
Menurut penjelasan Arrhennius, jelas
bahwa asam akan melepaskan kation Hidrogen (H+) jika terurai di dalam air,
sedangkan menurut Brownstead - Lowry asam merupakan zat yang di dalam reaksinya
akan mendonorkan proton (dalam hal ini akan mendonorkan kation). Sedangkan
menurut Lewis, asam akan menerima pasangan elektron bebas yang diberikan oleh
basa. Nah selain sifat - sifat di atas, asam juga dapat merubah warna lakmus
biru menjadi merah dan merubah warna indikator pH seperti indikator PP dari merah
(basa) menjadi tak berwarna (asam). Larutan asam apabila dicek menggunakan pH
universal atau pH meter akan menunjukkan angka < 7, dimana semakin mendekati
0 maka konsentrasi dan kekuatan asam semakin kuat.
Sifat
Fisika Asam
Ditinjau dari sifat fisika, asam memang
terasa masam walaupun tidak semua asam dapat dicicipi. Semua asam - asam
mineral bersifat korosif, yaitu mampu merusak dan dapat melarutkan permukaan
logam dan lapisan kulit jika terkena kontak langsung. Inilah alasan mengapa
asam akan menimbulkan sensasi tajam dan panas jika terkena kulit.
Sifat
Kimia Basa
Bisa dibilang basa adalah kebalikan dari
asam. Basa, menurut Arrhennius, adalah zat yang akan membebaskan anion
Hidroksida (OH-) jika dilarutkan di dalam air. Sedangkan menurut Brownstead - Lowry,
basa adalah zat yang akan menerima donor proton (H+) dari asam, dan menurut
Lewis basa akan mendonorkan pasangan elektron bebas kepada asam. Basa dapat
menetralkan asam membentuk garam dan air. Larutan basa dapat merubah warna
lakmus merah menjadi biru dan dapat merubah warna indikator PP dari tak
berwarna (asam) menjadi merah (basa).
Sifat
Fisika Basa
Dilihat dari sifat fisikanya, basa
memiliki rasa pahit walaupun basa tidak boleh dicicipi. Semua basa yang belum
dibuat menjadi larutannya akan berbentuk padatan, kecuali NH4OH yang dari awal
sudah berbentuk cairan. Jika kontak dengan kulit, basa akan terasa licin dan
beberapa basa seperti NaOH dan KOH dapat menyebabkan iritasi dan gatal - gatal
pada kulit. Basa juga sangat berbahaya bila kontak dengan selaput lendir
seperti mata, oleh karena itu hati - hati ya!
Permasalahan:
Seperti yang kita ketahui Sifat-sifat suatu unsur dalam satu golongan maupun periode menunjukkan pengulangan yang teratur (periodik). Bagaimanakah hubungan keempat sifat tersebut dalam suatu unsur?
DAFTAR PUSTAKA
·
pengertian.blogspot.co.id/2012/05/sifat-jari-jari-atom-ionisasi-afinitas.html
http://carolinframadhan.blogspot.co.id/2013/12/teori-asam-basa.html

























Apakah bahan bahan yang ada di alam dapat digunakan sebagai indikator untuk menentukan keasaman atau kebasaan suatu larutan?
BalasHapusterima kasih pertanyaannya.
Hapusiya, sebab untuk mengidentifikasi apakah bersiat asam atau basa dapat dilakukan dengan cara indikator buatan ddan indikator alami. adapun yang termasuk indikator alami antaranya berbagai bunga yang berwarna atau tumbuhan, seperti daun, mahkota bunga, kunyit, kulit manggis, dan kubis ungu dapat digunakan sebagai indikator asam basa. Ekstrak atau sari dari bahan-bahan ini dapat menunjukkan warna yang berbeda dalam larutan asam basa.
berikan contoh cara menentukan Jari-Jari Atom dan Keeloktronegatifan?
BalasHapusterima kasih atas pertanyaannya,
HapusJari-jari atom merupakan jarak elaktron terluar ke inti atom dan menunjukan ukuran suatu atom. Jari-jari atom sukar diukur sehingga pengukuran jari-jari atom dilakukan dengan cara mengukur jarak inti antar dua atom yang berikatan sesamanya.
Dalam suatu golongan, jari-jari atom semakin ke atas cenderung semakin kecil. Hal ini terjadi karena semakin ke atas, kulit elektron semakin kecil. Dalam suatu periode, semakin ke kanan jari-jari atom cenderung semakin kecil. Hal ini terjadi karena semakin ke kanan jumlah proton dan jumlah elektron semakin banyak, sedangkan jumlah kulit terluar yang terisi elekteron tetap sama sehingga tarikan inti terhadap elektron terluar semakin kuat.
Kelektronegatifan adalah kemampuan suatu atom untuk menarik elektron dari atom lain.keelektronegatifan (segolongan) makin ke bawah makin kecil, karena gaya taik-menarik inti makin lemah. Unsur-unsur bagian bawah dalam sistem periodik cenderung melepaskan elektron.keelektronegatifan (seperioda) makin kekanan makin besar.keelektronegatifan terbesar pada setiap periode dimiliki oleh golongan VII A (unsur-unsur halogen).
Apakah geometri molekul hanya ditujukan pada senyawa kovalen ataupun ion-ion poliatomik saja?
BalasHapusterima kasih pertanyaannya,
Hapusiya hanya ditunjukkan kepada senyawa kovalen dan io-ion poliatomik saja, sebab Geometri molekul atau sering disebut struktur molekul atau bentuk molekul yaitu gambaran tiga dimensi dari suatu molekul yang ditentukan oleh jumlah ikatan dan besarnya sudut-sudut yang ada disekitar atom pusat.
Perlu ditekankan istilah molekul hanya berlaku untuk atom-atom yang berikatan secara kovalen. Karena hal inilah, istilah geometri molekul hanya ditujukan pada senyawa kovalen ataupun ion-ion poliatomik.
Kapan suatu unsur dikatakan stabil Dan tidak stabil dalam afinitas elektron??
BalasHapusterima kasih pertanyaanya,
HapusUnsure dikatakan stabil jika jumlah elektron pada kulit terakhirnya (elektrom valensi) memenuhi aturan duplet (max 2 elektron pada kulit terakhir seperti konfigurasi ekektron unsur Helium) dan aturan octet (max 8 elektron pada kulit terakhir).Dan unsur dikatakan tidak stabil apabila jumlah elektron pada kulit terakhirnya tidak memenuhi aturan duplet maupun octet. Untuk mencapai kestabilan seperti halnya konfigurasi unsure gas mulia, unsure-unsur yang tidak stabil akan melepas dan/ menerima electron terakhir sehingga akan membentuk ion positif (jika melepas electron) dan/ ion negative (jika menerima elektron).
Bagaimana cara menentukan konfigurasi elektron?
BalasHapusterima kasih pertanyaanya,
Hapuscara menentukan atau menulis konfigurasi elektron hal yang pertama kali ditulis adalah tingkat energi kemudian subkulit dan terakhir jumlah elektron yang mengisinya (ditulis subscript). Ada tiga metode utama yang dapat dipakai untuk menuliskan konfigurasi elektron yaitu:
1. Cara Orbital Diagram adalah cara visual untuk merekonstruksi konfigurasi dengan menunjukkan masing-masing orbital secara terpisah. Cara ini dilakukan dengan terlebih dahulu menentukan subkulit (s, p, d, atau f) kemudian menuliskan elektron sesuai aturan-aturannya.
2. Notasi spdf, jumlah elektron untuk setiap tingkat energi dituliskan dalam angka subscript yang mengikuti tingkat energinya. Misalkan ada notasi spdf 1s2.
3. Notasi Gas Mulia adalah menuliskan lambang unsur gas mulia di dalam kurung siku sebagai pengganti konfigurasi gas mulia tersebut diikuti dengan konfigurasi sisanya.
Baiklah saya akan mencoba menjawab permasalahn diata tersebut dimana Sifat-sifat periodik unsur adalah sifat-sifat yang ada hubunganya dengan letak unsur pada sistem periodik. Sifat-sifat tersebut berubah dan berulang secara periodik sesuai dengan perubahan nomor atom dan konfigurasi elektron.
BalasHapus1. Jari-jari atom
Jari-jari atom merupakan jarak elaktron terluar ke inti atom dan menunjukan ukuran suatu atom. Jari-jari atom sukar diukur sehingga pengukuran jari-jari atom dilakukan dengan cara mengukur jarak inti antar dua atom yang berikatan sesamanya.
Dalam suatu golongan, jari-jari atom semakin ke atas cenderung semakin kecil. Hal ini terjadi karena semakin ke atas, kulit elektron semakin kecil. Dalam suatu periode, semakin ke kanan jari-jari atom cenderung semakin kecil. Hal ini terjadi karena semakin ke kanan jumlah proton dan jumlah elektron semakin banyak, sedangkan jumlah kulit terluar yang terisi elekteron tetap sama sehingga tarikan inti terhadap elektron terluar semakin kuat.
2. Energi ionisasi
Jika dalam suatu atom terdapat satu elektron di luar subkulit yang mantab, elektron ini cenderung mudah lepas supaya mempunyai konfigurasi seperti gas mulia. Namun, untuk melepaskan elektron dari suatu atom dperlukan energi. Energi yang diperlukan untuk melepaskan elektron dari suatu atom di namakan energi ionisasi. Dalam suatu periode semakin banyak elektron dan proton gaya tarik menarik elektron terluar dengan inti semakin besar (jari-jari kecil) Akibatnya, elektron sukar lepas sehingga energi untuk melepas elektron semakin besar. Hal ini berarti energi ionisasi besar.
Jika jumlah elektronnya sedikit, gaya tarik menarik elektron dengan inti lebih kecil (jari-jarinya semakain besar). Akibatnya, energi untuk melepaskan elektron terluar relatif lebih kecil berarti energi ionisasi kecil.
Unsur-unsur yang segolongan : energi ionisasi makin ke bawah makin kecil, karena elektron terluar akin jauh dari inti (gaya tarik inti makin lemah), sehingga elektron terluar makin mudah di lepaskan.
Unsur-unsur yan seperiode : energi ionisai pada umumnya makin ke kanan makin besar, karena makin ke kanan gaya tarik inti makin kuat.
Kekecualian :
unsur-unsur golongan II A memiliki energi ionisasi yang lebih besar dari pada golongan III A, dan energi ionisasi golongan V A lebih besar dari pada golongan VI A.
3. Keelektronegatifan
Kelektronegatifan adalah kemampuan suatu atom untuk menarik elektron dari atom lain. Faktor yang mempengaruhi keelektronegatifan adalahgaya tarik dari inti terhadap elektron dan jari-jari atom.
Unsur-unsur yang segolongan : keelektronegatifan makin ke bawah makin kecil, karena gaya taik-menarik inti makin lemah. Unsur-unsur bagian bawah dalam sistem periodik cenderung melepaskan elektron.
Unsur-unsur yang seperiode : keelektronegatifan makin kekanan makin besar.keelektronegatifan terbesar pada setiap periode dimiliki oleh golongan VII A (unsur-unsur halogen). Harga kelektronegatifan terbesar terdapat pada flour (F) yakni 4,0, dan harga terkecil terdapat pada fransium (Fr) yakni 0,7.
Harga keelektronegatifan penting untuk menentukan bilangan oksidasi ( biloks ) unsur dalam sutu senyawa. Jika harga kelektronegatifan besar, berati unsur yang bersangkutan cenderung menerim elektron dan membentuk bilangan oksidasi negatif. Jika harga keelektronegatifan kecil, unsur cenderung melepaskan elektron dan membentuk bilangan oksidasi positif. Jumlah atom yang diikat bergantung pada elektron valensinya.
4. Sifat Logam
Sifat-sifat unsur logam yang spesifik, antara lain : mengkilap, menghantarkan panas dan listrik, dapat ditempa menjadi lempengan tipis, serta dapat ditentangkan menjadi kawat / kabel panjang. Sifat-sifat logam tersebut diatas yang membedakan dengan unsur-unsur bukan logam.