1. Reaksi Substitusi
Reaksi substitusi adalah reaksi penggantian atom atau gugus atom oleh atom atau gugus atom lain. Jadi dalam reaksi substutisu suatu atom atau gugus atom yang terdapat dalam rantai utama akan meninggalkan rantai utama tersebut dan tempatnya yang kosong akan diganti oleh atom atau gugus atom yang lain. Berdasarkan pereaksi yang yang dipergunakan, reaksi substitusi dapat dibedakan menjadi (a) reaksi substitusi radikal bebas; (b) reaksi substitusi nukleofilik; dan (c) reaksi substitusi elektrofilik.
Reaksi substitusi merupakan reaksi yang melibatkan penggantian atom / gugus atom pada molekul dengan atom/gugus atom lainnya. Reaksi substitusi umumnya terjadi pada senyawa jenuh (tunggal) tanpa terjadi perubahan ikatan karakteristik (tetap jenuh). Suatu reaksi subtitusi terjadi bila sebuah atom atau gugus yang berasal dari pereaksi menggantikan sebuah atom atau gugus dari molekul yang bereaksi. Subtitusi dapat terjadi pada karbon jenuh maupun tidak jenuh.
Reaksi substitusi merupakan reaksi yang melibatkan penggantian atom / gugus atom pada molekul dengan atom/gugus atom lainnya. Reaksi substitusi umumnya terjadi pada senyawa jenuh (tunggal) tanpa terjadi perubahan ikatan karakteristik (tetap jenuh). Suatu reaksi subtitusi terjadi bila sebuah atom atau gugus yang berasal dari pereaksi menggantikan sebuah atom atau gugus dari molekul yang bereaksi. Subtitusi dapat terjadi pada karbon jenuh maupun tidak jenuh.
R – X + R’ – Y ---> R – Y + R’ – X
Atom karbon ujung suatu alkil halida mempunyai muatan positif parsial. Karbon ini bisa mudah diserang oleh anion dan spesi lain yang mempunyai sepasang elektron menyendiri (unshared) dalam kulit luarnya. Dihasilkan reaksi subtitusi ion atau gugus disubstitusikan untuk (menggantikan) atom, atau gugus lain. Beberapa reaksi substitusi pada senyawa karbon: - Reaksi pembentukan haloalkana
- Reaksi alkil halida dengan basa kuat
- Reaksi alkohol dengan PCl3
- Reaksi alkohol dengan logam Natrium
- Reaksi klorinasi
- Reaksi esterifikasi (pembentukan ester)
- Reaksi saponifikasi (penyabunan)
Reaksi Substitusi Radikal Bebas
Reaksi substitusi radikal bebas terjadi apabila gugus yang mengganti adalah radikal bebas. Pereaksi radikal bebas adalah atom atau gugus atom yang mengandung sebuah elektron yang tidak berpasangan. Pereaksi radikal bebas umumnya digunakan pada reaksi yang menyebabkan pemutusan homolitik dari substrat. Reaksi ini dimulai dengan pembentukan radikal bebas yang reaktif. Radikal tersebut beresaksi dengan molekul lain membentuk radikal bebas baru yang meneruskan reaksi berikutnya. Contoh reaksi substitusi radikal bebas adalah reaksi antara metana dengan gas klor mengasilkan monoklor-metana dan asam klorida.
Reaksi Substitusi Nukleofilik
Reaksi substitusi nukleofilik terjadi apabila gugus yang mengganti merupakan pereaksi nukleofil. Contoh reaksi substitusi nukleofilik adalah reaksi antara etanol dengan asam bromida menghasilkan etil-bromida.
Reaksi substitusi elektrofilik
Reaksi substitusi nukleofilik terjadi apabila gugus yang mengganti merupakan pereaksi elektrofil.
Reaksi substitusi merupakan reaksi yang melibatkan penggantian atom/gugus atom pada molekul dengan atom/gugus atom lainnya. Reaksi substitusi umumnya terjadi pada senyawa jenuh (tunggal) tanpa terjadi perubahan ikatan karakteristik (tetap jenuh)
A + B - C --> A - C + B
Contoh reaksi substitusi:
Reaksi pembentukan haloalkana: reaksi alkana dengan halogen
R - H + X2 --> R - X + H - X
Contoh:
CH3 - H + Cl2 --> CH3 - Cl + HCl
Reaksi substitusi atom H pada alkohol dengan logam reaktif (Na, K)
atom H pada gugus - OH dapat disubstitusi oleh logam reaktif seperti Na dan K
R - OH + Na --> R - ONa + H2
Contoh:
2 C2H5 - OH + 2 Na --> 2 C2H5 - ONa + H2
Reaksi alkoksi alkana (eter) dengan PCl5 menghasilkan haloalkana
R - O - R’ + PCl5 --> R - Cl + R’ - Cl + POCl3
Contoh:
CH3 - O - CH3 + PCl5 --> CH3Cl + CH3Cl +POCl3
Reaksi esterifikasi: reaksi pembentukan ester dari alkohol dan asam karboksilat
R - OH + R’ - COOH --> R’ - COOR + H - OH
Contoh
CH3 - OH + CH3 - COOH --> CH3 - COOCH3 + H2O
2. Reaksi eliminasi
Pengertian Reaksi Eliminasi
Reaksi eliminasi adalah suatu jenis reaksi organik dimana dua substituen dilepaskan dari sebuah molekul baik dalam satu atau dua langkah mekanisme. Reaksi satu langkah disebut dengan reaksi E2, sedangkan reaksi dua langkah disebut dengan reaksi E1. Harap diingat bahwa simbol angka pada huruf E (yang berarti elimination) tidak melambangkan jumlah langkah. E2 dan E1 menyatakan kinetika reaksi, yaitu berturut-turut bimolekuler dan unimolekuler.
Pada sebagian besar reaksi eliminasi organik, minimal satu hidrogen dilepaskan membentuk ikatan rangkap dua. Dengan kata lain akan terbentuk molekul tak jenuh. Hal tersebut memungkinkan sebuah molekul melangsungkan reaksi eliminasi reduktif, dimana valensi atom pada molekul menurun dua. Jenis reaksi eliminasi yang penting melibatkan alkil halida, dengan gugus pergi (leaving group) yang baik, bereaksi dengan basa Lewis membentuk alkena. Perhatikan contoh reaksi eliminasi berikut ini:
Reaksi eliminasi adalah kebalikan dari reaksi adisi. Ketika senyawa yang tereliminasi asimetris, maka regioselektivitas ditentukan oleh aturan Zaitsev.
Mekanisme E2
E2 merupakan reaksi eliminasi bimolekuler. Reaksi E2 hanya terdiri dari satu langkah mekanisme dimana ikatan karbon-hidrogen dan karbon-halogen terputus membentuk ikatan rangkap C=C. Reaksi E2 dilangsungkan oleh alkil halida primer dan sekunder. Reaksi ini hampir sama dengan reaksi SN2. Reaksi E2 secara khusus menggunakan basa kuat untuk menarik hidrogen asam dengan kuat. Perhatikan gambar berikut:
 |
| Suatu basa kuat digunakan untuk menarik hidrogen asam |
Mekanisme E1
E1 merupakan reaksi eliminasi unimolekuler. E1 terdiri dari dua langkah mekanisme yaitu ionisasi dan deprotonasi. Ionisasi adalah putusnya ikatan karbon-halogen membentuk intermediet karbokation. Reaksi E1 biasanya terjadi pada alkil halida tersier. Reaksi ini berlangsung tanpa kuat, melainkan dengan basa lemah (dalam suasana asam dan suhu tinggi). Reaksi E1 mirip dengan reaksi SN1, karena sama-sama menggunakan intermediet karbokation.
Perhatikan dua langkah reaksi E1 berikut ini:
Perhatikan dua langkah reaksi E1 berikut ini:
Langkah 1 (ionisasi)
Langkah 2 (deprotonasi)
Pada reaksi eliminasi, molekul senyawa berikatan tunggal berubah menjadi senyawa berikatan rangkap dengan melepas molekul kecil. Jadi, eliminasi merupakan kebalikan dari adisi.
Contoh:
Eliminasi air (dehidrasi) dari alkohol. Apabila dipanaskan dengan asam sulfat pekat pada suhu sekitar 1800C, alkohol dapat mengalami dehidrasi membentuk alkena.
Untuk membedakan ketiga jenis reaski di atas dapat dilakukan dengan melihat ciri2nya yang dengan mudah akan teramati :
- Pada reaksi subtitusi ruas kanan dan ruas kiri tidak terdapat ikatan rangkap atau bila di ruas kiri ada ikatan rangkap maka ruas sebelah kanan masih ada ikatan rangkap tersebut.
- sedangkan pada reaksi adisi mempunyai ciri ruas sebelah kanan (sebelum reaksi) terdapat ikatan rangkap sedangkan di ruas sebelah kiri (setelah reaksi) ikatan rangkap tersebut hilang atau berkurang dari rangkap 3 menjadi rangkap 2.
- kemudian pada reaksi eliminasi mempunyai ciri2 kebalikan dari reaksi adisi, yakni di ruas sebelah kiri tidak ada ikatan rangkap kemudian di ruas sebelah kanan menjadi ada ikatan rangkapnya.
3. Reaksi adisi
Reaksi adisi adalah reaksi senyawa karbon yang melibatkan penggabungan molekul-molekul. Reaksi adisi juga dapat diartikan sebagai reaksi pemutusan ikatan rangkap (tak jenuh) menjadi ikatan tunggal (jenuh). Reaksi adisi ini terjadi pada senyawa tidak jenuh (mempunyai ikatan rangkap). Molekol tidak jenuh dapat menerima tambahan atom atau gugus dari pereaksi tanpa melebihi angka koordinasi maksimum dari atomnya sendiri. Ikatan rangkap dua dan rangkap tiga karbon-karbon dan rangkap dua karbon-oksigen merupakan jenis struktur yang paling umum yang mengalami reaksi adisi.
Contoh reaksi substitusi:
Reaksi adisi alkena dengan halogen
Reaksi adisi dengan brom digunakan untuk membedakan senyawa alkena (C = C) dengan siklo alkana. Hal ini karena kedua senyawa mempunyai isomer fungsional (rumus molekul sama, tetapi gugus fungsi berbeda). Pengamatan reaksinya dengan membedakan warna dari brom yaitu merah coklat. Alkena dapat bereaksi dengan brom sehingga warna merah coklat dari brom hilang menjadi tidak berwarna. Akan tetapi, sikloalkana tidak bereaksi dan warna merah coklat dari brom tetap. Alkena + brom ---> bereaksi, warna merah coklat dari brom hilang Sikloalkana + brom ↛ tidak bereaksi, warna merah coklat dari brom tetap.
Reaksi adisi alkena dengan senyawa asam halida (H - X)
Dalam adisi ini atom X terikat pada C rangkap dikiri atau dikanan akan menghasilkan senyawa yang berbeda, kecuali kalau R dengan R’ sama. Untuk itu, ada aturan yang menetapkan hasil utama dari reaksi adisi tersebut yang dikemukankan oleh Vlademir Markovnikov. Aturan Markovnikov :
- ikatan rangkap merupakan kumpulan elektron
- gugus alkil merupakan gugus pendorong elektron. Alkil makin besar, daya dorong makin kuat. Urutan kekuatan alkil : - CH3, - C2H5, - C3H7
- gugus elektrongatif merupakan gugus penarik elektron. Makin elektronegatif, daya tarik elektron makin kuat.
Adisi Nukleofil : reaksi penambahan suatu gugus ke suatu ikatan rangkap dan hasilkan ikatan tunggal, dimana gugus yang menyerang pertama kali berupa pereaksi nukleofil.
Adisi Elektrofil gugus penyerang berupa pereaksi elektrofil.
Contoh : AB + C = C ---> A – C – C – B H2 + CH2 = CH2 ---> CH3 – CH3
Contoh : AB + C = C ---> A – C – C – B H2 + CH2 = CH2 ---> CH3 – CH3
Adisi Radikal Bebas gugus penyerang merupakan radikal bebas.
Contoh : CH4 + Cl. ---> CH3 + HCl
Contoh : CH4 + Cl. ---> CH3 + HCl
Reaksi adisi H2 pada alkena membentuk alkana
C2H5 - CH = CH - CH3 + H2 ---> C2H5 - CH2 - CH2 - CH3 Reaksi hidrogenasi ini digunakan untuk membuat margarin (mentega tiruan) dari minyak yang mengandung asam lemak tak jenuh (C = C). Minyak cair dihidrogenasi dengan bantuan katalis Ni menghasilkan lemak padat.
Reaksi adisi H2 pada alkanal membentuk alkohol primer
Ikatan rangkap C = O pada alkanal bereaksi dengan H2 untuk menghasilkan alkohol primer.
Disebut juga dengan reaksi reduksi karena terjadi penurunan bilangan oksidasi C.
Reaksii adisi H2 pada keton/alkanon menghasilkan alkohol sekunder
Ikatan rangkap C = O pada alkanon/keton bereaksi dengan H2 untuk menghasilkan alkohol sekunder.Reaksi H2O pada asam karboksilat menghasilkan suatu alkohol sekunder
Ikatan rangkap C = O pada asam karboksilat akan terbuka akibat penambahan reduktor kuat untuk menghasilkan alkohol primer
Permasalahan:
Pada sebagian besar reaksi eliminasi organik, minimal satu hidrogen dilepaskan membentuk ikatan rangkap dua. mengapa atom hidrogen yang dilepaskan? bagaimana mekanisme kerja dari pelepasan hidrogen tersebut?







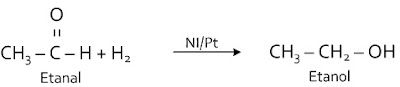
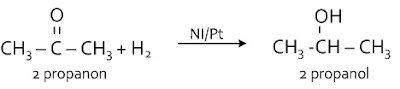

Berikan contoh reaksi substitusi dan eliminasi? Terima kasih
BalasHapusContoh reaksi substitusi:
Hapus1) Reaksi pembentukan haloalkana: reaksi alkana dengan halogen
Contoh:
CH3 - H + Cl2 --> CH3 - Cl + HCl
2) Reaksi substitusi atom H pada alkohol dengan logam reaktif (Na, K)
Contoh:
2 C2H5 - OH + 2 Na --> 2 C2H5 - ONa + H2
3) Reaksi alkoksi alkana (eter) dengan PCl5 menghasilkan haloalkana
Contoh:
CH3 - O - CH3 + PCl5 --> CH3Cl + CH3Cl +POCl3
Contoh reaksi eliminasi
1) Reaksi eliminasi H2 dari alkana menjadi alkena
CH3 - CH2 - CH3 --> CH3 - CH = CH2 + H2
2) Reaksi eliminasi air (dehidrogenasi) dari alkohol
CH3 - CH2 - OH --> CH2 = CH2 + H2O
Mengapa sebuah molekul melangsungkan reaksi eliminasi reduktif ?
BalasHapusTerimakasih
Pada sebagian besar reaksi eliminasi organik, minimal satu hidrogen dilepaskan membentuk ikatan rangkap dua. Dengan kata lain akan terbentuk molekul tak jenuh. Hal tersebut memungkinkan sebuah molekul melangsungkan reaksi eliminasi reduktif, dimana valensi atom pada molekul menurun dua.
HapusBisakah anda berikan contoh dari reaksi suntitusi dan reaksi eliminasi selain contoh yang anda sebutkan di atas!
BalasHapusRekasi substitusi
HapusCH4(g) + Cl2(g)→ CH3Cl(g) + HCl(g)
CH3Cl(g) + Cl2(g)→CH2Cl2(g) + HCl(g)
CH2Cl2(g) + Cl2(g)→CHCl3(g) + HCl(g)
CHCl3(g) + Cl2(g)→CCl4(g) + HCl(g)
Contoh reaksi eliminasi
1) Reaksi eliminasi H2 dari alkana menjadi alkena
CH3 - CH2 - CH3 --> CH3 - CH = CH2 + H2
2) Reaksi eliminasi air (dehidrogenasi) dari alkohol
CH3 - CH2 - OH --> CH2 = CH2 + H2O
Apa bedanya reaksi substitusi dan eliminasi?
BalasHapusReaksi substitusi merupakan reaksi yang melibatkan penggantian atom/gugus atom pada molekul dengan atom/gugus atom lainnya. Reaksi substitusi umumnya terjadi pada senyawa jenuh (tunggal) tanpa terjadi perubahan ikatan karakteristik (tetap jenuh) sedangkan Reaksi eliminasi merupakan reaksi peruraian suatu molekul menjadi molekul-molekul lain di mana salah satu molekul dikatakan tereliminasi. Reaksi eliminiasi dapat juga dikatakan sebagai reaksi pembentukan ikatan rangkap dari ikatan tunggal (kebalikan dari reaksi adisi).
HapusTolong jelaskan maksud Reaksi eliminasi adalah kebalikan dari reaksi adisi?
BalasHapusTerimakasih
Reaksi eliminasi adalah kebalikan dari reaksi adisi. Ketika senyawa yang tereliminasi asimetris, maka regioselektivitas ditentukan oleh aturan Zaitsev.
HapusPada sebagian besar reaksi eliminasi organik, minimal satu hidrogen dilepaskan membentuk ikatan rangka dua. Dengan kata lain akan terbentuk molekul tak jenuh. Hal tersebut memungkinkan bahwa sebuah molekul melangsungkan reaksi eliminasi reduktif, dimana valensi atom pada molekul menurun dua. Jenis reaksi eliminasi yang penting melibatkan alkil halida, dengan gugus pergi (leavig group) yang baik, bereaksi dengan basa lewis membentuk alkena. Contoh reaksi eliminasi :
BalasHapusReaksi eliminasi adalah kebalikan dari reaksi adisi. Ketika senyawa yang tereliminasi asimetris, maka regioselektivitas ditemukan oleh aturan Zaitsev.
Bila ada soal uraian, lalu kita disuruh mengerjakan, namun tidak ada tulisan harus di substitusikan/eliminasi/adisi, bagaimana cara kita untuk mengetahui diapakan soal tersebut? Misalnya di substitusikan, eliminasikan, atau di adisikan. Makasih
BalasHapus