STEREOKIMIA
Stereokimia merupakan ilmu yang mempelajari tentang struktur 3 dimensi dari molekul. Perlu diketahui bahwa stereokimia ini sangatlah penting. bahkan karena seterokimia ini, sebuah struktur yang memiliki rumus molekul sama hanya karena susunannya berbeda akan mengakibatkan fungsi yang berbeda pula, hal ini sering terjadi di dunia kesehatan. pada produk hasil sintesis. produk berupa rasemat, yaitu dua produk isomer yang berlawanan strukturnya.
Stereokimia adalah susunan ruang dari atom dan gugus fungsi dalam molekul umumnya, molekul organik dalam obyek tiga dimensi yang merupakan hasil hibridisasi dan ikatan secara geometri dari atom dalam molekul. Artinya bagaimana atom-atom dalam sebuah molekul diatur dalam ruang satu terhadap ruang yang lainnya. Stereokimia berkaitan dengan bagaimana penataan atom-atom dalam sebuah molekul dalam ruang tiga dimensi.
Stereokimia adalah susunan ruang dari atom dan gugus fungsi dalam molekul umumnya, molekul organik dalam obyek tiga dimensi yang merupakan hasil hibridisasi dan ikatan secara geometri dari atom dalam molekul. Artinya bagaimana atom-atom dalam sebuah molekul diatur dalam ruang satu terhadap ruang yang lainnya. Stereokimia berkaitan dengan bagaimana penataan atom-atom dalam sebuah molekul dalam ruang tiga dimensi.
Adapun tiga aspek yang mencakup dari stereokimia ini ialah :
· Konformasi molekul: Berkaitan dengan bentuk molekul dan bagaimana bentuk molekul itu diubah akibat adanya putaran bebas disepanjang ikatan C-C tunggal.
· Konfigurasi berkaitan dengan Kiralitas molekul: Bagaimana penataan atom-atom disekitar atom karbon yang mengakibatkan terjadinya isomer..
· Isomer Geometrik : Terjadi karena ketegaran (rigit) dalam molekul yang mengakibatkan adanya isomer.
Isomer adalah senyawa-senyawa karbon yang memiliki rumus molekul sama tetapi rumus strukturnya berbeda. Pada senyawa hidrokarbon, rumus kimia menunjukkan jumlah atom karbon dan setiap unsur yang terdapat dalam satu molekul senyawa.
Kelompok isomer :
Terdapat dua jenis isomer, yaitu isomer struktural dan stereoisomer . Isomer struktural adalah isomer yang berbeda dari susunan/urutan atom-atom terikat satu sama lain.
1. ISOMER STRUKTURAL
Variasi dalam struktur senyawa organic dapat disebabkan oleh jumlah atom atau jenis atom dalam molekul. Tetapi variasi dalam struktur ini dapat juga terjadi Karena urutan atom yang terikat satu sama lain dalam suatu molekul.
Misalnya untuk rumus molekul C2H6O dapat ditulis dua rumus bangun yang berlainan. Kedua rumus bangun ini menyatakan dua senyawa yang berlainan yaitu: dimetil eter, dan etanol. Dimetil eter dan etanol merupakan contoh isomer structural. Alkana yang mengandung tiga karbon atau kurang tak mempunyai isomer. Dalam tiap kasus, hanya terdapat satu cara untuk menata atom-atom.
Contoh :
Tak berisomer : CH4 C2H6 C3H8
Metana Etana Propana
Jadi dapat disimpulkan semakin banyak atom karbonnya, maka makin banyak pula isomernya.
2. STEREOISOMER
Merupakan senyawa berlainan yang mempunyai struktur sama, berbeda hanya dalam hal penataan atom-atom dalam ruangannya saja. Stereoisomer bukanlah isomer struktur,mereka mempunyai urutan keterkaitan atom-atom yang sama. Stereoisomer hanya berbeda susunan atom-atomnya dalam ruang. Berdasarkan strukturnya stereoisomer digolongkan menjadi dua yaitu :
· Enantiomer adalah yang antara satu sama lain merupakan bayangan cermin
· Diastereomer adalah yang bukan merupakan bayangan cermin
Berdasarkan mudah tidaknya berubah dari satu stereoisomer ke stereoisomer yang lain, stereoisomer dikelompokan menjadi dua kelompok, yakni :
· Isomer-isomer konformasi / konfomer-konfomer yaitu mereka yang dapat berubah dari satu stereoisomer ke stereoisomer yang lain dengan hanya melalui pemuatan ikatan tunggal
· Isomer-isomer konfigurasi yaitu mereka yang hanya dapat berubah dari satu stereoisomer ke stereoisomer yang lain melalui pemutusan dan penyambungan kembali ikatan-ikatan kovalen.
isomer ialah senyawa berbeda dengan formula kimia yang sama. 2 kelas utama isomer tersebut yaitu: Konstitusional isomer dan stereoisomer. Konstitusional isomer berbeda pada cara atom tersebut terhubung satu sama lain. Sifatnya yaitu:
- Nama IUPAC yang berbeda
- Gugus fungsi bisa sama tau beda
- Sifat fisik yang berbeda, sehingga bisa dipisahkan dengan pemisahan yang didasarkan perbedaan sifat fisik seperti distilasi
- Sifat kimia yang berbeda. sehingga direaksikan akan menghasilkan produk yang berbeda pula
Stereoisomer hanya berbeda pada cara atom berorientasi pada ruang. Stereoisomer memiliki nama IUPAC yang identik(kecuali kata depan seperti trans atau cis). Memiliki gugus fungsi yang sama. Susunan dari tiga dimensi disebut konfigurasi. Stereoisomer hanya berbeda dalam konfigurasinya.
A. ISOMERI GEOMETRI DALAM ALKENA DAN SENYAWA SIKLIK
1.isomer geometri dalam alkena
Isomer geometri terjadi karena ketegaran (rigidity) dalam molekul dan hanya dijumpai dalam dua kelompok senyawa yaitu alkena dan senyawa siklik.
Jika suatu gugus atau atom terikat oleh ikatan sigma saja (sp3, umumnya pada senyawa yang berikatan tunggal), maka gugus atau atom yang terikat tersebut dapat berputar sedemikian rupa sehingga bentuk molekulnya akan selalu sama.
Contoh :
Berbeda halnya dengan gugus atau atom yang terikat oleh ikatan rangkap dimana ada ikatan sigma dan pi dalam molekul (sp2). Gugus atau atom ini tidak dapat berotasi tanpa mematahkan ikatan pi –nya terlebih dahulu. Sehingga ada sifat ketegaran adalam molekul yang menyebabkan jika letak atom atau gugusnya berbeda, maka sifat senyawa tersebut berbeda pula. Artinya lagi kedua senyawa tersebut adalah berbeda.
Contoh :
Kedua senyawa diatas adalah berbeda dimana pada senyawa pertama letak atom Cl-nya sesisi sedangkan pada senyawa kedua letak atom Cl-nya berbeda sisi. Senyawa pertama tidak mudah diubah menjadi senyawa kedua, begitu juga sebaliknya karena ikatan rangkap antara atom karbonnya berisifat tegar.
Jika dalam senyawa, dua gugus atau atom yang sama terletak pada satu sisi ikatan pi, maka disebut dengan cis, dan jika letaknya berlwanan disebut dengan trans.
isomerisme cis dan trans atau atau isomerisme geometrik atau isomerisme konfigurasi adalah sebuah bentuk stereoisomer yang menjelaskan orientasi gugus gugus fungsi dalam sebuah molekul. Secara umum, isomer seperti ini mempunyai ikatan rangkap yang tidak dapat berputar. Selain itu, isomer ini juga muncul dikarenakan struktur cincin molekul yang menyebabkan perputaran ikatan sangat terbatas.
Istilah "isomerisme geometrik" adalah istilah lama yang sudah tidak digunakan lagi dan merupakan sinonim dari "isomerisme cis-trans". Ia kadang-kadang juga merupakan sinonim untuk stereoisomerisme umum (misalnya isomerisme optis); istilah yang tepat untuk stereoisomerisme non-optis adalah diastereomerisme.
Terdapat dua bentuk isomer cis-trans, yakni cis dan trans Ketika gugus substituen berorientasi pada arah yang sama, diastereomer ini disebut sebagai cis, sedangkan ketika subtituen berorientasi pada arah yang berlawanan, diastereomer ini disebut sebagai trans. Contoh molekul hidrokarbon yang menunjukkan isomerisme cis-trans adalah 2-butena senyawa yang mengandung ikatan rangkap (seperti alkena), ikatan rangkap tersebut akan bersifat kaku sehingga tidak dapat berputar karena ikatan rangkap ini tidak dapat berputar, maka ketika ada dua senyawa yang memiliki struktur berbeda, itu artinya kedua senyawa tersebut memang merupakan dua senyawa yang berbeda sifat. Dengan kata lain, dua senyawa tersebut adalah isomer satu sama lain.
Isomer geometri dalam Alkena (Cis dan Trans). Diakibatkan oleh ketegarandalam molekul. Dijumpai dalam dua kelas senyawa: alkena dan senyawa siklik.Senyawa yang mempunyai ikatan rangkap tak dapat berputar dengan ikatanrangkap sebagai sumbunya, tanpa mematahkan ikatan pi nya.
Karena kekakuanikatan pi, gugus-gugus yang terikat pada ikatan pi terletak tetap dalam ruang relatifsatu sama lain.Syarat isomer geometri dalam alkena, yaitu tiap atom karbon yang terlibatdalam ikatan pi mengikat dua gugus yang berlainan, misalnya H dan Cl. Jika salahsatu atom karbon berikatan rangkap itu mempunyai dua gugus identik, misalny adua atom H atau dua gugus CH3 maka tak mungkin terjadi isomeri geometri.
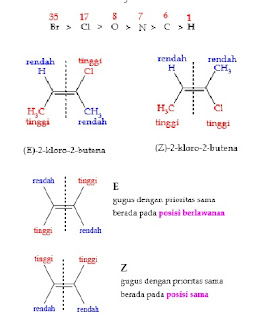
a. Sistem Tata Nama (E) dan (Z)
Aturan Penandaan E dan Z untuk membedakan isomer alkena dengan duasubstituen dapat kita gunakan istilah cis-trans.
Jika substituen dengan prioritas yang sama berposisi sama maka diberi tanda Z ( Zussamen) sedangkan jika posisinya berlawanan diberi tanda E ( Entgegen).Aturan yang digunakan untuk memberikan urutan prioritas disebut aturan Cahn-Ingold-Prelog (diambil dari nama ilmuwan yang menemukannya). Aturan-aturan tersebut adalah sebagai berikut: Aturan 1 : Lihat pada atom yang terikatlangsung pada karbon ikatan rangkap lalu urutkan substituen tersebut berdasarkannomor atomnya.
Klorin memiliki nomor atom lebih besar dibandingkan karbon, sehinggasubstituen Cl menerima prioritas lebih tinggi dibandingkan metil.Aturan 2 : Jika pengurutan prioritas tidak dapat dilakukan menggunakan atom pertama yang terikat langsung pada karbon ikatan rangkap maka gunakan prioritasatom berikutnya. Substituen -CH2 CH3 dan – CH3 memiliki prioritas yang sama jikadigunakan aturan 1 karena kedua atom yang terikat langsung pada karbon ikatanrangkap adalah atom karbon juga. Dengan aturan 2, gugus etil menerima prioritaslebih tinggi dari pada metil karena etil memiliki prioritas lebih tinggi pada atomkedua. Atom karbon yang terikat pada karbon ikatan rangkap, masih mengikat satukarbon lain, sedangkan atom kedua pada gugus metil adalah hidrogen.
b. Aturan Deret
Aturan deret untuk prioritas :
1) Jika atom-atom yang dipermasalahkan berbeda-beda, maka urutanderet ditentukan oleh nomor atom. Atom dengan nomor atom tinggimemperoleh prioritas.F < Cl < Br < ISemakin tinggi nomor atom, maka prioritas semakin naik.
2) Jika atom-atom itu adalah isotop satu sama lain, maka isotop dengannomor massa tinggi memperoleh prioritas.H D Nomor massa 1 < 23)
3) Jika kedua atom tersebut identik, maka nomor atom dari atom-atom berikutnya digunakan untuk memberikan prioritas. Jika atom-atom tersebut juga mengikat atom-atom identik, maka prioritas ditentukan pada titik pertamakali dijumpai perbedaan dalam menyusuri rantai. Atom yang mengikat suatuatom dengan prioritas tinggi akan diprioritaskan (jangan menjumlakan nomor-nomor atom, melainkan mencari atom tunggal yang berprioritas tinggi).4)
4) Atom-atom yang terikat oleh ikatan rangkap atau ikatan ganda tigadiberi kesetaraan (equivalenceis) ikatan tunggal, sehingga atom-atom ini dapatdiperlakukan sebagai gugus-gugus berikatan tunggal, dalam menentukan prioritas. Tiap atom berikatan rangkap diduakalikan (atau ditigakalikan untukikatan ganda tiga).
alkana asikloik(rantai terbuka) dengan sikloalkana memiliki sifat kimia yang mirip. Keduanya sama-sama non polar dan cenderung inert. Akan tetapiterdapat perbedaan mendasar Pertama, sikloalkana kurang fleksibel dibandingkandengan alkana rantai terbuka. Ikatan tunggal (ikatan sigma) pada alkana asliklikdapat berputar.Pada sikloalkana, ikatan yang terbentuk kurang bebas untuk berputar.Misalnya siklopentana, bentuknya adalah segitiga rigid dan planar. Putaran padaikatan karbon-karbon tidak mungkin terjadi tanpa merusak cincin.
karena strukturnya yang siklik, sikloalkana memiliki dua sisi yaitu sisi atas dan bawah. Hal ini memungkinakn sikloheksana memiliki kemungkinanisomerisme berdasarkan letak substituennya. Contohnya, ada dua bentuk isomerdari 1,2-dimetilsiklopropana. Pertama dengan dua gugus metil pada sisi yang sama,kedua dengan gugus metil pada posisi yang berlawanan. Kedua bentuk isomermerupakan molekul yang stabil, dan dapat dikonfersi dari bentuk satu ke bentuklainnya tanpa memecah cincin atau tanpa membentuk ikatan baru.
B. KONFORMASI DAN KIRALITAS SENYAWA RANTAI TERBUKA

Kiralitas
Konformasi Senyawa Rantai Terbuka
Rumus struktur menunjukkan cara di mana atom dari molekul terikat bersama-sama (konstitusi), tetapi umumnya tidak menggambarkan bentuk tiga dimensi dari molekul, kecuali notasi ikatan khusus (misalnyawedge dan garis putus-putus) yang digunakan. Pentingnya formula deskriptif seperti tiga dimensi menjadi jelas dalam membahas stereoisomerisme configurational, di mana orientasi relatif dari atom di ruang angkasa adalah tetap oleh molekul ikatan konstitusi (misalnya ikatan rangkap dan cincin). Di sini juga tercatat bahwa prefiks nomenklatur harus digunakan ketika penamaan stereoisomer tertentu. Dalam bagian ini kita akan memperluas pandangan kami tiga dimensi dari struktur molekul untuk memasukkan senyawa yang biasanya menganggap array menyeimbangkan tiga dimensi orientasi spasial, yang bersama-sama ciri senyawa diisolasi sama.dalam senyawa tantai terbuka gugus-gugus yang terikat oleh ikatan sigma dapat berotasi mengelilingi ikatan itu. Oleh Karena itu atom-atom dalam suatu molekul rantai terbuka dapat memiiki penataan dalam ruang secara berlain-lainan, kami menyebutnya orientasi spasial yang berbeda dari atom dari molekul yang dihasilkan dari rotasi atau memutar sekitar ikatan tunggal yaitukonformasi.

Untuk mengemukakan konformasi akan digunakan tiga jenis rumus: rumus dimensional, rumus bola dan pasak, dan proyeksi Newman. Rumus bola dan pasak dan rumus dimensional adalah representasi tiga dimensi dari model molekul suatu senyawa. Proyeksi Newman merupakan pandangan ujung ke ujung dari dua atom karbon saja dalam molekul itu. Ikatan yang menghubungkan kedua atom ini tersembunyi. Ketiga ikatan karbon depan tampak menuju ke pusat proyeksi, dan ketiga ikatan dari karbon belakang hanya tampak sebagian. Proyeksi Newman dapat digambar untuk molekul dengan dua atom atau lebih. karena pada tiap kali hanya dua atom karbon dapat ditunjukkan dalam proyeksi itu, maka lebih dari satu proyeksi Newman dapat digambar untuk sebuah molekul.
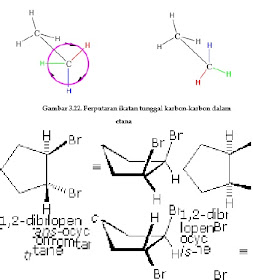
Etana alkana sederhana memberikan pengenalan yang baik untuk analisis konformasi. Berikut hanya ada satu ikatan karbon-karbon, dan struktur rotasi (rotamers) bahwa mungkin menganggap jatuh di antara dua ekstrem, goyang dan eklips. Dalam uraian berikut penurut ini, beberapa notasi struktur yang digunakan. Pertama memandang molekul etana dari samping, dengan ikatan karbon-karbon menjadi horizontal untuk pembaca. Hidrogen kemudian terletak di ruang sekitarnya dengan wedge (di depan proyeksi) dan putus putus (belakang proyeksi) ikatan. Jika struktur ini diputar sehingga karbon # 1 adalah miring ke bawah dan membawa lebih dekat ke penonton, yang "kuda-kuda" Proyeksi disajikan. Akhirnya, jika pembaca melihat ke bawah ikatan karbon-karbon dengan karbon # 1 di depan # 2, proyeksi Newman terlihat.
Karena adanya rotasi mengelilingi ikatan sigma, maka suatu molekul dapat memiliki konformasi berapa saja. Konformasi yang berbeda-beda itu disebut konformer ("conformational isomers"). Karena konformer dapat dapat dengan mudah diubah satu bebas dari yang lain, seperti isomer struktural.
Rotasi mengelilingi ikatan sigma seringkali disebut rotasi bebas, tetapi sebenarnya rotasi ini tidaklah benar-benar bebas. Sebagai hasil dari tolakan elektron-elektron ikatan dan atom-atom hidrogen, diilustrasikan di sebelah kanan atas, konformasi eklips kurang stabil daripada konformasi goyang oleh sekitar 3 kkal / mol (rantai goyang). Tolakan yang paling parah di konformasi eklips digambarkan oleh panah merah. Ada enam tolakan kurang kuat lain yang tidak ditampilkan. Dalam konformasi goyangada enam tolakan ikatan yang sama, empat di antaranya ditunjukkan oleh panah biru, dan ini semua substansial kurang parah daripada tiga tolakan dikalahkan terkuat. Akibatnya, energi potensial yang terkait dengan berbagai konformasi etana bervariasi dengan sudut dihedral ikatan, seperti yang ditunjukkan di bawah ini. Meskipun penurut etana berada dalam keseimbangan yang cepat dengan satu sama lain, 3 kkal / mol perbedaan energi mengarah ke dominan besar konformasi goyang (> 99,9%) pada waktu tertentu.
Meskipun sterik dan tolak menolak antara electron- elektron merupakan penjelasan yang paling populer untuk konformasi etana, interaksi orbital molekul juga telah diusulkan sebagai faktor signifikan.
Butana (CH3CH2CH2CH3) dapat memiliki konformasi eklips dan goyang. Dalam butana terdapat dua gugus metil yang relatif besar, terikat pada dua karbon pusat. Dipandang dari kedua karbon pusat, hadirnya gugus-gugus metal ini menyebabkan terjadinya dua macam konformasi goyang, yang berbeda dalam hal posisi gugus-gugus metil terpisah sejauh mungkin. Kepentingan tertentu dan pentingnya adalah konformasi dihasilkan oleh rotasi tentang ikatan karbon-karbon pusat. Di antaranya kita akan fokus pada dua konformasi goyang(A & C) dan dua konformasi eklips (B & D), ditunjukkan di bawah ini di beberapa stereo-representasi. Seperti dalam kasus etana, yangkonformasi goyang lebih stabil daripadakonformasi eklips dikalahkan oleh 2,8-4,5 kkal / mol. Karena konformasi goyang mewakili komponen utama dari sampel butana mereka telah diberi sebutan awalan mengidentifikasi anti untuk A dan canggung untuk C.
Konformasi goyang dalam mana gugus metil terpisah sejauh mungkin, disebut conformer anti (Yunani: anti, “melawan”). Konformasi goyang ini di mana gugus-gugus lebih berikatan, disebut conformer gauche (Prancis: gauche, “kiri” atau “terkelit”).
Makin besar gugus-gugus yang terikat pada kedua atom karbon, akan makin besar selisih energi antara konformasi-konfirmasi molekul itu. Diperlukan lebih banyak energi untuk mendorong dua gugus besar agar berdekatan daripada gugus kecil.
Kiralitas
Suatu molekul dikatakan kiral/chiral (ky-ral dalam bahasa Yunani cheir, berarti “tangan”) adalah dimana jika suatu molekul tidak dapat dihimpitkan dengan bayangan cerminnya berarti kedua senyawa enantiomer. Enantiomer adalah bayangan cermin yang tidak dapat dihimpitkan dan merupakan molekul yang berbeda.
Bagaimana cara kita mengetahui suatu molekul tersebut kiral atau tidak ? Caranya dengan melihat apakah mengandung sisi simetri (plane of simetry). Molekul yang tidak kiral jika mengandung sisi simetri. Sisi simetri yang dimaksud adalah sisi datar yang dipotong melewati tengah-tengah dari molekul. Sebagai contoh tabung Erlenmeyer mempunyai sisi simetri. Jika kita memotong tabung Erlenmeyer secara vertikal, akan nampak sisi satu akan merupakan bayangan cermin sisi yang lain. Salah satu tangan kita mempunyai sisi simetri karena sisi setengahnya bukan merupakan bayangan cermin. Molekul yang mempunyai sisi simetris dalam berbagai kemungkinan dalam konformasinya harus identik dengan bayangan cermin dan karena itu merupakan senyawa nonkiral atau biasa disebut akiral.
Kebanyakan, walau tidak semua, penyebab adanya kiralitas pada suatu senyawa dikarenakan adanya atom karbon yang mengikat empat gugus berbeda. Seperti karbon tetrahedral yang berikatan dengan empat gugus yang berbeda. Atom karbon tersebut merupakan sifat dari keseluruhan molekul, dimana pusat kiralitas adalah ciri struktur yang menyebabkan kiralitas.
Proyeksi Fischer merupakan rumus proyeksi untuk menunjukkan penataan ruang dari gugus-gugus di sekitar atom kiral. Dalam menggambarkan suatu proyeksi Fischer, diandaikan bahwa molekul itu diulur (stretched) sepenuhnya dalam bidang kertas dengan semua subtituennya eklips, tanpa memperdulikan konformasi apapun yang disukai. Proyeksi Fischer berbentuk tiga dimensi. Karbon kiral berada di perpotongan garis vertikal dan horizontal. Garis horizontal menunjukkan ikatan yang berada keluar dari kertas ke arah. Garis vertikal menunjukkan ikatan yang berada dibelakang kertas menjauhi pengamat.Karbon teroksidasi tertinggi berada di paling atas. Bila menggunakan proyeksi Fischer kita dapat dengan mudah menemukan enansiomer, mudah menemukan bayangan cermin dalam bidang, mudah untuk digambar.
Permasalahan:
Mengapa sikloalkana kurang fleksibel jika dibandingkan dengan alkana rantai terbuka?














Assalamualaikum, mengapa Stereokimia penting untuk di pelajari? terimakasih
BalasHapusWa'alaikumsalam
Hapusstereokimia penting untuk dipelajari karena stereokimia berhubungan dengan kehidupan kita sehari-hari. stereokimia dapat diartikan sebagai ilmu yang mempelajari tentang struktur ruang dalam kimia, dalam hal ini mempelajari stereokimia dapat berguna bagi manusia agar bisa mengetahui bagaimana susuna atom-atom dalam suatu senyawa. Relevansi stereokimia terhadap pengetahuan lainnya yaitu bahwa kita dapat mengetahui apa saja dalam ilmu pengetahuan serinci mungkin. Contohnya dapat kita lihat dari kehidupan kita yaitu dari bangunan rumah bagian dari dalam maupun diluar rumah sudah tertata dan tersusun secara rapi seperti ruang tamu yang terletak dibagian paling depan rumah dan dapur diletakan pada bagian belakang rumah dan bagian-bagian lainnya yang sudah tersusun rapi.
Saya ingin bertanya.
BalasHapusMengapa Semakin tinggi jumlah atom dari atom substituen langsung, semakin tinggi prioritasnya jelaskan?
Menetapkan prioritas untuk substituen ikatan ganda dengan melihat atom yang melekat langsung ke karbon ikatan rangkap.
Hapus1. Semakin tinggi jumlah atom dari atom substituen langsung, semakin tinggi prioritas.
Misalnya, H- <C- <N <O- <Cl-. (Prioritas meningkat kiri ke kanan)
(Isotop yang berbeda dari unsur yang sama ditugaskan prioritas sesuai dengan massa atom mereka.)
2. Jika dua substituen memiliki atom substituen langsung sama, pindah ke atom berikutnya (jauh dari ikatan ganda) sampai perbedaan ditemukan.
Misalnya, CH3- <C2H5- <ClCH2- <BrCH2- <CH3O-.
Setelah prioritas relatif dari dua substituen pada masing-masing karbon ikatan ganda telah ditentukan, orientasi cis dari pasangan prioritas yang lebih tinggi ditunjuk Z, dan orientasi trans disebut E. Menerapkan aturan ini untuk isomer senyawa A dan B ditunjukkan di atas, kita menetapkan konfigurasi isomer 1-bromo-1-chloropropene sebagai E (Br memiliki prioritas lebih tinggi dari Cl, dan CH3 prioritas yang lebih tinggi daripada H). Konfigurasi isomer 1-siklobutil-2-etil-3-metil-1-butena bertekad untuk menjadi Z (C4H7 memiliki prioritas lebih tinggi dari H, dan kelompok isopropil memiliki prioritas lebih tinggi daripada kelompok etil). Contoh berikut menguraikan penentuan prioritas untuk kasus yang lebih kompleks.
Disini saya ingin bertanya dapatkah Anda menjelaskan isomerisme cis-trans pada siklo alkana?
BalasHapusTerima kasih
Bila sikloalkana mengikat substituen pada dua atau lebih atom karbon, maka terjadi isomer cis-trans. Salah satu contohnya adalah pada 1,2-dimetilsiklopentana. Dalam penggambaran strukturnya, cincin siklopentana digambarkan sebagai segilima datar, dengan ketentuan bila kedua substituennya terletak pada sisi yang sama dari bidang cincin dinamakan isomer cis, sedangkan bila berseberangan dengan bidang cincin dinamakan isomer trans. Pada sikloheksana juga dijumpai isomer-isomer cis-tans, yang bila digambarkan dengan konformasi kursi, yang masing-masing substituen dapat berposisi aksial atau ekuatorial.
Hapusbagaimana cara menentukan kiral dan akiral dalam senyawa rantai terbuka?
BalasHapusbaiklah saya akan mencoba menjawab : Jika ada dua atau lebih gugus yang sama terikat pada suatu karbon tetrahedral, maka molekul tersebut adalah akiral dan superimposible terhadap bayangan cerminnya.Sebagai contoh adalah molekul 2-propanol.Cara lain untuk menentukan apakah suatu molekul kiral atau akiral adalah dengan melihat ada atau tidaknya bidang simetri dalam molekul. Bidang simetri adalah suatu bidang khayal yang membagi dua molekul sehingga bagian-bagian tersebut merupakan bayangan cermin antara satu dengan yang lainnya. Jika suatau molekul mempunyai bidang simetri maka molekul tersebut akiral, contohnya 2-kloropropana. Sebaliknya jika suatu molekul tidak memiliki bidang simetri maka molekul tersebut adalah akiral, contohnya 2-klorobutena.
Hapusterima kasih
Tolong sebutkan perbedaan cis dan trans??
BalasHapusIsomer cis dan isomer trans sering kali memiliki sifat-sift fisika yang berbeda. Perbedaan antara isomer pada umumnya disebabkan oleh perbedaan bentuk molekul atau momen dipol secara keseluruhan. Perbedaan ini dapatlah sangat kecil, seperti yang terlihat pada titik didih alkena berantai lurus 2-pentena (titik didih isomer trans 36 °C dan isomer cis 37 °C)[1]. Perbedaan isomer cis dan trans juga dapat sangat besar, seperti pada kasus siklooktena. Isomer cis senyawa ini memiliki titik didih 145 °C[2], sedangkan isomer transnya 75 °C.[3] Perbedaan yang sangat besar antara kedua isomer siklooktena disebabkan oleh terikan cincin yang besar untuk trans-siklooktena, yang juga menyebabkannya kurang stabil dibandingkan isomer cis. Bahkan, kedua isomer asam 2-butenadioat memiliki sifat-sifat dan reaktivitas yang sangat berbeda sehingga mempunyai nama yang berbeda pula. Isomer cisnya disebuah asam maleat, sedangkan isomer transnya disebuat asam fumarat. Polaritas merupakan faktor kunci yang menentukan titik didih relatif senyawa karena ia akan meningkatkan gaya antar molekul, sedangkan simetri merupakan faktor kunci yang menentukan titik leleh relatif karena ia mengizinkan penataan molekul yang lebih baik pada bentuk padat. Oleh karena itu, trans-alkena yang kurang polar dan lebih simetris cenderung memiliki titik didih yang lebih rendah dan titik leleh yang lebih tinggi. Sebaliknya cis-alkena secara umum memiliki titik didih yang lebih tinggi dan titik leleh yang lebih rendah.
Hapus